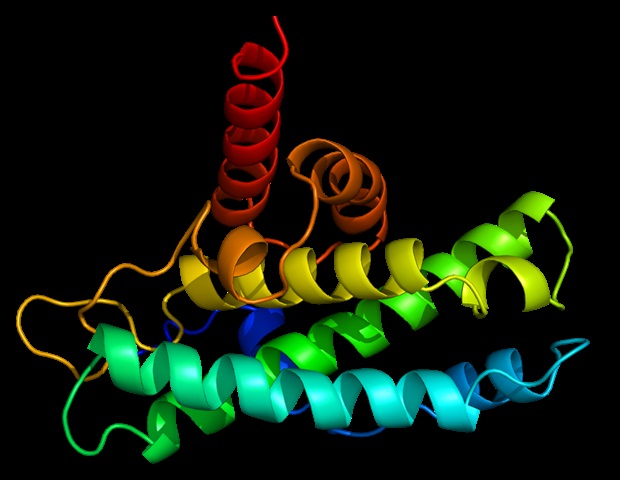
Dans le paysage moléculaire complexe de la cellule, la coordination des protéines nécessite un contrôle précis pour éviter les maladies. Si certaines protéines doivent être synthétisées à des moments précis, d’autres nécessitent qu’elles soient décomposées et recyclées au moment opportun. La dégradation des protéines est un processus essentiel qui affecte les activités cellulaires telles que le cycle cellulaire, la mort cellulaire ou la réponse immunitaire. Au cœur de ce processus se trouve le protéasome, centre de recyclage de la cellule. Le protéasome dégrade les protéines si elles portent une étiquette moléculaire constituée d’une chaîne de molécules d’ubiquitine. La tâche de lier cette étiquette incombe à des enzymes appelées ubiquitine ligases.
Ce processus, appelé polyubiquitination, a longtemps été difficile à étudier en raison de sa nature rapide et complexe. Pour relever ce défi, les scientifiques de l’Institut de recherche en biologie moléculaire (IMP) de Vienne, de l’École de médecine de l’Université de Caroline du Nord et leurs collaborateurs ont utilisé une gamme de techniques, combinant la microscopie électronique cryogénique (cryo-EM) avec l’état de -les techniques de l’art. Algorithmes d’apprentissage profond. « Notre objectif était de capturer la multiubiquitination étape par étape grâce à des études cryo-EM résolues dans le temps », a déclaré David Hasselback, Ph.D., chef de groupe à l’IMP. « Cette méthode nous a permis de visualiser et de disséquer les interactions moléculaires complexes qui se produisent au cours de ce processus, comme dans un film en stop-motion.»
Intervalle de temps biochimique
L’étude a été publiée dans la revue nature structurale et biologie moléculaire, Plonge dans les mouvements du complexe promoteur anaphase/cyclosome (APC/C), une enzyme ubiquitine qui pilote le cycle cellulaire. Les mécanismes sous-jacents à la liaison de l’APC/C à la signalisation de l’ubiquitine restent un mystère non résolu. Hasselback et Nicholas Brown, Ph.D., professeur agrégé de pharmacologie à l’École de médecine de l’UNC, sont co-auteurs principaux.
Nous avions une solide compréhension de la structure sous-jacente d’APC/C, qui est une condition préalable au cryo-EM résolu dans le temps. « Nous comprenons désormais mieux sa fonction, à chaque étape du processus. »
Tatiana Bodrog, Ph.D., auteur principal, est chercheuse postdoctorale en pharmacologie à l’UNC-Chapel Hill.
Les ligases d’ubiquitine remplissent de nombreuses fonctions, notamment le recrutement de différents substrats, l’interaction avec d’autres enzymes et la formation de différents types de signaux d’ubiquitine. Les scientifiques ont visualisé les interactions entre les protéines liant l’ubiquitine, APC/C, et leurs coenzymes. Ils ont reconstruit les mouvements subis par l’APC/C au cours du processus de multilocalisation en utilisant une forme d’apprentissage profond appelée réseaux de neurones. Il s’agissait du premier du genre dans la recherche sur la dégradation des protéines.
APC/C fait partie d’une grande famille d’ubiquitine ligases (> 600 membres) qui n’a pas encore été décrite de cette manière. Les efforts mondiaux continueront de repousser les limites de ce domaine.
« La clé du succès de notre travail a été la collaboration avec de nombreuses autres équipes », a déclaré Brown, qui est également membre du UNC Lineberger Comprehensive Cancer Center. « À Princeton, les contributions d’Ellen Chung dans le domaine des logiciels et de la programmation ont été fondamentales pour découvrir de nouvelles connaissances sur le mécanisme APC/C. La validation ultérieure de ces résultats a nécessité l’aide de plusieurs autres groupes dirigés par les Drs Harrison, Stemmel, Han, Emanuel, et Zhang. « L’effort collectif a été crucial pour faire avancer nos recherches jusqu’à la ligne d’arrivée. »
L’importance de cette recherche va au-delà de son impact direct, ouvrant la voie à de futures explorations de la régulation des ligands, promettant à terme des connaissances plus approfondies sur les mécanismes sous-jacents au métabolisme des protéines, importants pour la santé humaine et les maladies, telles que de nombreuses formes de cancer.
source:
Référence du magazine :
Bodrog, T., et autres. (2023). Analyse cryo-EM (TR-EM) résolue dans le temps de la polyubiquitination du substrat par le complexe/cyclosome favorisant l’anaphase RING E3 (APC/C). Nature structurale et biologie moléculaire. est ce que je.org/10.1038/s41594-023-01105-5.