science
Vers un mécanisme de dissociation des liaisons induite par les rayonnements ionisants dans l’oxygène, l’eau et la fragmentation de la guanine et de l’ADN: une simulation de la théorie fonctionnelle de la densité.

Notre modèle de squelette d’ADN est similaire au résidu de désoxyribose utilisé dans d’autres Ab – initio Des calculs comme Ref.33 Où le système d’intérêt consiste en un noyau d’ADN qui a été modelé par un groupe amino attaché à un désoxyribose, comme indiqué sur les Fig. 2a – c. Le cycle sucre désoxyribose est un composant important des nucléotides et joue un rôle dans la stabilisation de la structure en double hélice de l’ADN. Tout endommagement de l’anneau de sucre provoque la rupture des fils et la formation d’une rupture de fil unique (SSB). La formation d’une paire de SSB dans des brins opposés, dans les dix paires de bases, entraîne une fracture simple à double brin (DSB).
Notre modèle de squelette d’ADN est similaire aux résidus de désoxyribose utilisés dans d’autres calculs tels que les refs.12,33 Dans lequel le système d’intérêt consiste en un noyau d’ADN modifié par un groupe amino attaché à un désoxyribose en présence d’un radical OH- comme le montre la figure 4 dans la réf.1 2. Dans les modèles à gros grains, tels que QM-MM, il est possible d’ajouter toute la structure de la guanine (ou de toute autre base) à l’anneau de sucre et d’étendre le fragment d’ADN en une molécule plus grande, en manipulant une partie dans le QM et une autre. au moyen d’un champ de force de mécanique moléculaire (MM) classique, voir par exemple réf.14.
Pour étudier l’effet des rayonnements ionisants sur les particules, nous avons systématiquement effectué un calcul DFT des particules dans différents états de charge. Pour un représentant à base d’ADN, nous considérons la guanine en plus des molécules d’oxygène et d’eau dans nos simulations.
L’effet de l’extraction d’électrons sur la molécule d’oxygène
Les espèces d’oxygène sont connues pour jouer un rôle important dans les cellules cancéreuses et normales sous rayonnement. Les cellules cancéreuses ont généralement moins d’oxygène dans un environnement complexe appelé hypoxie, elles sont donc plus résistantes aux radiations que les tissus normaux.
Pour le rayonnement à faible transport linéaire (LET), les cellules irradiées dans des conditions toxiques conservent environ 2,9 fois plus d’espaceurs appariés (DSB) que les cellules irradiées dans des conditions hypoxiques. Cela indique qu’une diminution significative de la concentration en oxygène a un effet plus important par rapport à la concentration normale en oxygène dans la cellule34.
Il a également été suggéré que l’appauvrissement en oxygène entraîne une réduction de la toxicité tissulaire normale aux débits de dose FLASH qui se produisent dans les femto à nanosecondes de rayonnement, car les dommages biomoléculaires sont réduits dans un environnement avec des niveaux d’oxygène vix.16. De plus, il existe des transitions spécifiques dans l’oxygène qui rendent l’oxygène moléculaire toxique, comme l’oxygène unique. Ainsi, il est important de comprendre la stabilité de la molécule d’oxygène car elle joue un rôle crucial dans ce que l’on appelle l’effet d’appauvrissement en oxygène et si l’environnement de rayonnement induit par la charge facilite la dissociation de la molécule d’oxygène.
Tout d’abord, l’oxygène (O\(_{2}\)) la molécule a été optimisée et la distance de liaison et l’énergie d’équilibre ont été obtenues. La longueur de la liaison OO s’est avérée être de 1,233 Å, ce qui est cohérent avec les valeurs de calcul expérimentales et précédemment rapportées. Pas moi\(_{2}\) molécule, nous notons que l’extraction progressive des électrons montre initialement une légère contraction de la longueur de la liaison, puis se dilate lorsqu’un grand nombre d’électrons sont éliminés (voir Fig. 3). La variation de la longueur de la liaison en fonction de l’état de charge de la molécule d’oxygène est présentée dans le tableau 1. L’élimination des électrons affaiblit la force de la liaison et donc l’énergie de dissociation de la liaison diminue. Dans une molécule d’oxygène pur, l’énergie de dissociation des liaisons est plus forte du fait de la formation de doubles liaisons (119 kcal/mol soit 5,15 V/liaison).
La figure 3 montre la longueur de la liaison en fonction de l’état de charge (q). L’étiquette de l’axe des x 1 indique l’état de charge +1 avec un électron retiré, ce qui entraîne une charge positive dans la molécule. Nous avons remarqué qu’avec q = +4 (4 électrons retirés), cela montre une dissociation des liaisons. La distance (d = 7,5 Å) est due à la taille de boîte choisie de 15 Å, ce qui indique qu’ils sont isolés les uns des autres.
L’effet de l’élimination d’un électron dans une molécule d’oxygène. Les points représentent une liaison O – O et la distance relative de la liaison est indiquée par les atomes O.
Effet de l’extraction d’électrons sur les molécules d’eau
molécules d’eau (H\(_{2}\)O) est omniprésent et joue un rôle important dans les processus vitaux, et est stabilisé en tant que molécule triatomique avec C2v La symétrie moléculaire et l’angle de liaison est de 104,5\(^{\circ}\) entre un atome d’oxygène et deux atomes d’hydrogène. La longueur de liaison H – O est proche de la longueur de liaison (O – H) de 0,9572 Å et de l’angle de liaison (H – O – H) de 104,5 \(^{\circ}\). Nos données calculées sont en bon accord avec les rapports expérimentaux, comme le montre le tableau 2. Nous avons observé que lorsque des électrons sont extraits d’une molécule d’eau, les longueurs de liaison (H – OH) et l’angle de liaison (H – O – H) changent de manière significative comme montré dans les Fig. 4 et 5. Notez que ces calculs ont été effectués dans le vide. Le chemin de dissociation d’une molécule d’eau, entourée d’autres molécules d’eau, sera significativement différent car en milieu aqueux la formation de radicaux OH est plus probable. Dans la figure 3, aucun de ces scénarios ne correspond à la formation d’un radical OH, simplement à cause de la symétrie géométrique d’un seul H.\(_2\)O molécule et l’état limite périodique utilisé dans le calcul DFT.
La dissociation de la liaison HO – H dans une molécule d’eau prend 118,8 kcal/mol (497,1 kJ/mol) lorsqu’aucune charge n’est impliquée. L’énergie de liaison des liaisons O – H d’une molécule d’eau est d’environ 110,3 kcal/mol (461,5 kJ/mol)35. Dans le cas d’un environnement ionisant, ces valeurs seront réduites et, par conséquent, la réduction conduit à une fragmentation facile des liaisons, comme le montre la figure 4. La figure 5 montre comment la longueur et les angles des liaisons changent avec l’augmentation de l’élimination des électrons d’un composé aqueux.
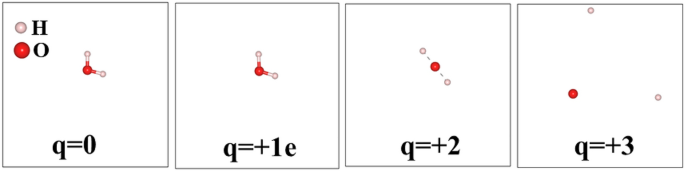
L’effet d’enlever un électron dans une molécule d’eau.
Pour un environnement hautement ionisant, les angles de liaison s’écartent d’anguleux à planaires avant que les liaisons ne soient rompues, comme indiqué pour le cas de charge (q = 2). Cela indique que l’extraction des deux électrons par molécule d’eau est (3.20435324 \(\fois 10^{-19}\) coulombs par molécule) sont suffisants pour entraîner la fragmentation en ions.
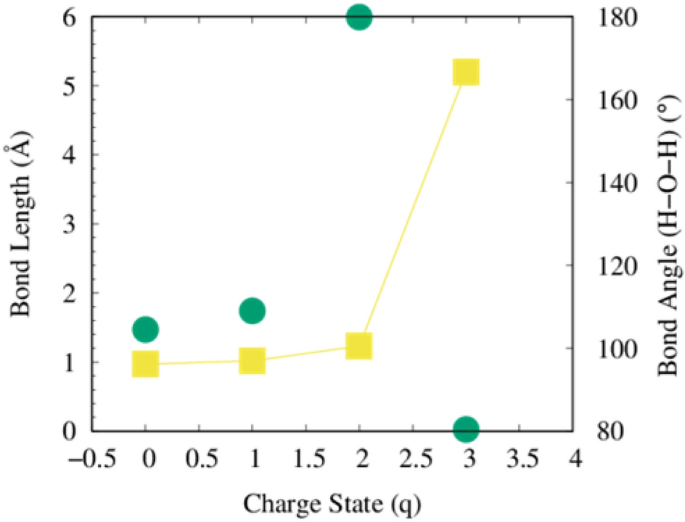
L’effet d’enlever un électron dans une molécule d’eau. Les points représentent les angles de liaison H – O – H.
Effet de l’extraction d’électrons sur la guanine et sur un fragment d’une molécule d’ADN
Dans cette sous-section, nous présentons l’effet de l’extraction d’électrons sur la guanine et une partie de la molécule d’ADN. La guanine, comme le montre la figure 6, est l’une des quatre principales nucléobases de l’ADN. (2-amino-1,9-dihydro-6H-purin-6-one : IUPAC) consiste en un système cyclique pyrimidine-imidazole condensé avec des doubles liaisons conjuguées et a une structure moléculaire plane. Pour éviter l’interaction parasite due à la condition aux limites périodiques (PBC) dans le calcul DFT, un grand carré simulé a été adopté pour chaque molécule. Parce que ces molécules ont des liaisons multiples, au lieu d’observer la longueur d’une seule liaison, nous observons la somme des déplacements atomiques par rapport aux configurations élémentaires. La fragmentation progressive de la molécule de guanine est observée comme illustré à la Fig. 7. La somme correspondante des états de déplacement des atomes en fonction des états de charge est illustrée à la Fig. 8. Nous avons observé que lorsque l’état de charge est 4e, le La double liaison C-C est rompue, ce qui entraînera une instabilité structurelle.
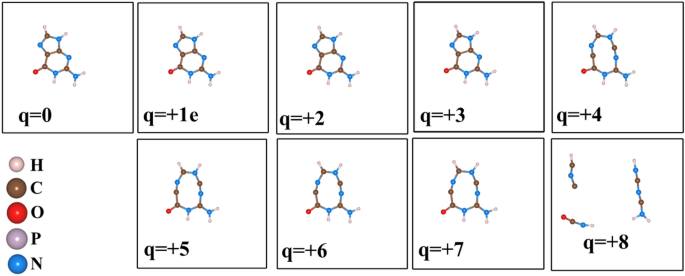
L’effet de l’élimination d’un électron dans une molécule de guanine.
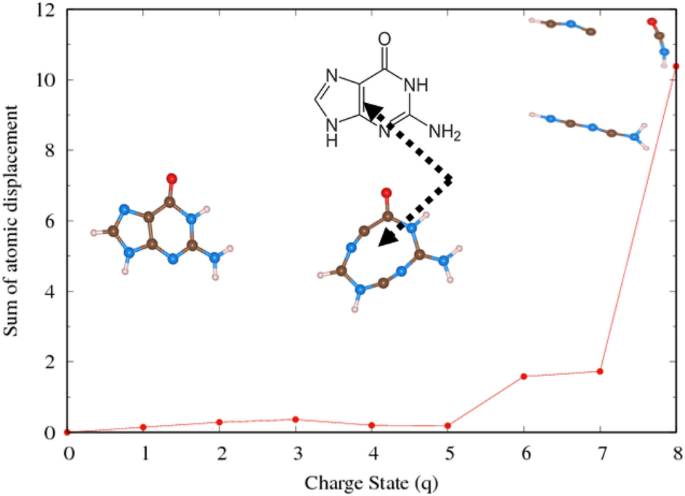
Déplacement total des atomes en fonction de la charge (q) dans la guanine. La somme du déplacement en Å et de la charge en termes de nombre d’électrons supprimés.
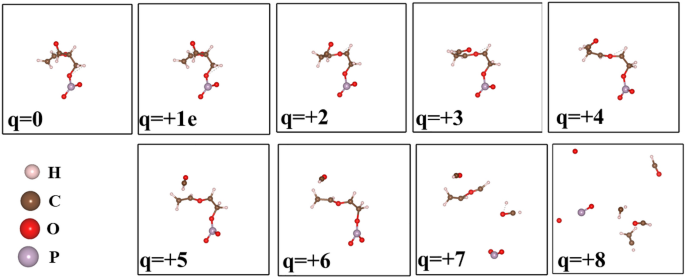
L’effet d’enlever un électron dans un segment d’une molécule d’ADN.
De même, lorsque des électrons sont extraits d’un segment d’ADN comme le montre la figure 8, les liaisons commencent à changer et à se séparer lorsque le changement est suffisant, tel que q = 4e. Finalement, la molécule commence à se décomposer en fragments plus petits dans un environnement d’ionisation suffisamment élevé. Cela indique que ces particules sont susceptibles de se dégrader lorsqu’elles sont exposées à un environnement de rayonnement ionisant.
Les rayonnements ionisants peuvent extraire des électrons de ces molécules, ce qui donne des ions pouvant entraîner une dissociation des liaisons. Nos résultats indiquent que le rayonnement affecte directement la structure atomique de l’ADN en provoquant une fragmentation. De plus, il peut y avoir des effets secondaires tels que la création d’espèces réactives de l’oxygène qui oxydent les protéines et les lipides, causent des dommages à l’ADN et, finalement, l’effet global peut provoquer la mort cellulaire et une catastrophe mitotique.36.
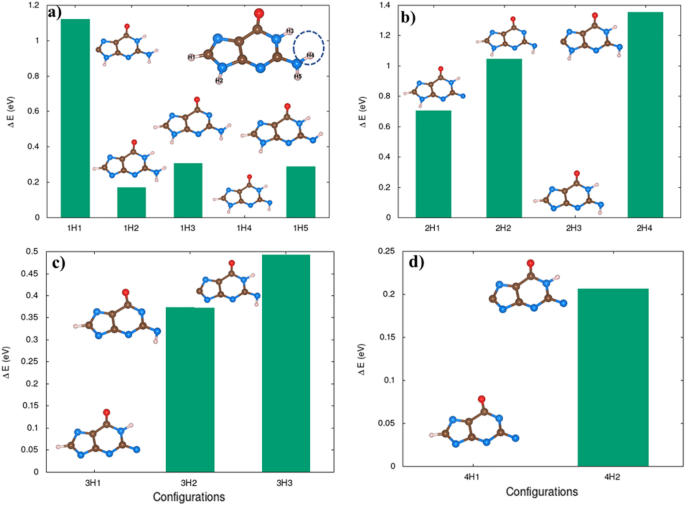
L’effet de la déshydrogénation dans la molécule de guanine. Notation — 1H1 dénote H retiré de la première configuration, 1H5 dénote 1H retiré qui est la cinquième configuration. De même, atome 2H1:2H supprimé qui est la première configuration considérée et ainsi de suite. L’énergie de formation se rapporte à la configuration la plus énergétiquement stable de tous les H.
Effet de la teneur en hydrogène sur l’extraction des électrons et la stabilité de l’ADN
Les molécules déficientes en hydrogène, les principaux dommages à l’ADN dans le processus indirect, ont été examinées afin de vérifier leur dépendance à la dissociation induite par la charge. Pour illustrer, les atomes H ont été progressivement retirés de la guanine, comme le montre la figure 9. Fait intéressant, la fragmentation des molécules se produit avec moins d’élimination d’électrons. Un cycle guanine périodique est stable pour charger l’état 3e s’il passe trois atomes d’hydrogène. La géométrie moléculaire de la guanine montre une modification significative du dénudage des atomes 4 ou 5 H. En cas de déficit en 5H, l’état de charge du 3e sépare complètement la molécule dans la chaîne moléculaire.
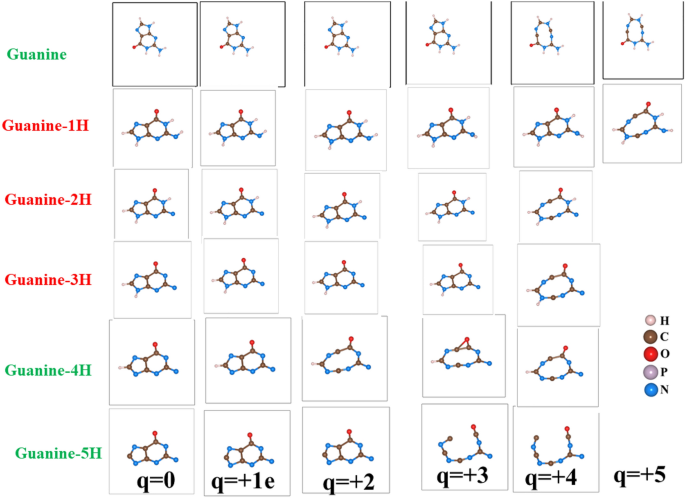
L’effet d’extraction d’électrons dans l’hydrogène a réduit la molécule de guanine.
D’après nos calculs, la guanine ne se dissocie que lorsque les atomes H (\(q = 0\) dans la Figure 10). L’effet combiné de la charge et de l’environnement à faible teneur en H, comme le montre la figure 10, fragmentera ces particules. Cela indique que la dissociation induite par la charge des particules dépend fortement de l’environnement d’hydrogène. Notez que la redéfinition de la géométrie moléculaire des guanines après élimination des atomes H, a entraîné des géométries initiales légèrement différentes. Différentes configurations structurelles en fonction du nombre de processus d’extraction d’hydrogène de la guanine affectent la stabilité de la molécule en raison de l’élimination ultérieure des électrons. La géométrie améliorée s’est montrée différemment si nous avions d’abord supprimé les électrons. Par conséquent, ces deux processus, l’extraction d’hydrogène et l’élimination des électrons ne se transfèrent pas car leur structure moléculaire optimale correspondante n’est pas identique. Cette observation indique l’effet d’un changement structurel local dans le scénario réel de dommages à l’ADN, car le décapage H est un processus beaucoup plus lent par rapport aux dommages directs qui consistent essentiellement en l’élimination des électrons.
Étant donné que les dommages indirects sont un processus lent, en raison de la réaction-diffusion des radicaux OH, nous attribuons des dommages directs suivis de dommages indirects à l’interaction de l’ADN avec une seule voie de rayonnement responsable de l’étendue linéaire dans le modèle de survie cellulaire au carré linéaire. Le deuxième scénario, à savoir l’élimination de H et l’ionisation directe ultérieure, est le plus pertinent pour les dommages à l’ADN induits par deux voies pertinentes pour le terme quadratique dans le modèle quadratique de survie cellulaire linéaire.
Il est essentiel de souligner que les codes Monte Carlo (MC) actuels utilisés pour étudier l’effet des rayonnements sur les matériaux biologiques manquent de détails car ils utilisent certaines valeurs empiriques pour l’excitation et les dommages à l’ADN.24,37 Par conséquent, le calcul actuel des premiers principes fournit des paramètres d’entrée importants à prendre en compte dans ces modèles.

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
science
Des astronomes ont découvert des « embouteillages » de trous noirs dans les centres galactiques

Couple normal individuel de M• = 107M⊙ problème. Les lignes noires montrent le couple de type I ainsi que le couple GW. Les lignes violettes représentent le couple thermique, tandis que les lignes bleues représentent le couple total. Panneau de gauche : couple tracé dans l’espace R. Panneau de droite : couple tracé dans l’espace τ. Les lignes verticales pointillées indiquent τ± (vert) et τ0 (rouge), endroits où des pièges migratoires sont susceptibles de se produire. crédit: Avis mensuels de la Royal Astronomical Society (2024). est ce que je: 10.1093/mnras/stae828
× Fermer
Couple normal individuel de M• = 107M⊙ problème. Les lignes noires montrent le couple de type I ainsi que le couple GW. Les lignes violettes représentent le couple thermique, tandis que les lignes bleues représentent le couple total. Panneau de gauche : couple tracé dans l’espace R. Panneau de droite : couple tracé dans l’espace τ. Les lignes verticales pointillées indiquent τ± (vert) et τ0 (rouge), endroits où des pièges migratoires sont susceptibles de se produire. crédit: Avis mensuels de la Royal Astronomical Society (2024). est ce que je: 10.1093/mnras/stae828
Une étude internationale, dirigée par des chercheurs de l'Université Monash, a révélé des informations importantes sur la dynamique des trous noirs au sein des disques massifs situés au centre des galaxies.
Publié dans Avis mensuels de la Royal Astronomical Society, l'étude Il montre les processus complexes qui déterminent quand et où les trous noirs ralentissent et interagissent les uns avec les autres, conduisant potentiellement à des fusions.
Les résultats de l’étude mettent en évidence les émissions d’ondes gravitationnelles (GW) provenant de la fusion des trous noirs, événements qui peuvent être détectés par des instruments tels que le Laser Gravitational Wave Observatory (LIGO).
Lorsque deux trous noirs se rapprochent trop, ils perturbent l’espace-temps lui-même, émettant des ondes gravitationnelles avant de finalement fusionner en un seul trou.
Le Dr Evgeny Grishin, chercheur postdoctoral à l'École de physique et d'astronomie de l'Université Monash qui a dirigé l'étude, a comparé le phénomène à une intersection très fréquentée sans feux de signalisation fonctionnels.
« Nous avons examiné combien et où nous aurions ces intersections très fréquentées », a déclaré le Dr Grishin.
La recherche s'est concentrée sur les centres des galaxies, où les trous noirs peuvent fusionner plusieurs fois en raison de l'énorme force gravitationnelle du trou noir supermassif situé au centre.
De plus, la présence d’un disque d’accrétion massif de gaz contribue à la luminosité de ces galaxies, les classant parmi les noyaux galactiques actifs (AGN).
L'interaction entre les trous noirs plus petits et le gaz environnant les fait migrer à l'intérieur du disque, s'accumulant dans des régions appelées pièges à migration. Ces pièges augmentent la possibilité de collisions rapprochées entre trous noirs, pouvant conduire à des fusions.
« Les effets thermiques jouent un rôle crucial dans ce processus, affectant l'emplacement et la stabilité des pièges migratoires. Cela implique notamment que nous ne voyons pas de pièges migratoires se produire dans les galaxies actives à grande luminosité », a déclaré le Dr Grishin.
Les résultats de l’étude font progresser notre compréhension des fusions de trous noirs et ont des implications plus larges pour l’astronomie des ondes gravitationnelles, l’astrophysique des hautes énergies, l’évolution des galaxies et la rétroaction des noyaux galactiques actifs.
« Malgré ces découvertes importantes, beaucoup de choses sur la physique des trous noirs et de leurs environnements restent inconnues », a déclaré le Dr Grishin. « Nous sommes satisfaits des résultats et nous sommes désormais sur le point de découvrir où et comment les trous noirs fusionnent dans les noyaux galactiques.
« L’avenir de l’astronomie des ondes gravitationnelles et de la recherche sur les noyaux galactiques actifs est exceptionnellement prometteur. »
Plus d'information:
Evgeny Grishin et al., Effet du couple thermique sur les pièges de migration des disques AGN et les amas d'ondes gravitationnelles, Avis mensuels de la Royal Astronomical Society (2024). est ce que je: 10.1093/mnras/stae828
Informations sur les magazines :
Avis mensuels de la Royal Astronomical Society

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
science
La fusée Falcon 9 de SpaceX vient de terminer une mission historique

SpaceX lance et fait atterrir des fusées depuis 2015, même si certains de ces premiers atterrissages ne se sont pas déroulés comme prévu et se sont soldés par une boule de feu.
De nos jours, les atterrissages sont en grande partie terminés et mardi soir, la compagnie de vols spatiaux a réussi son 300e atterrissage réussi de première étape. Elon Musk, PDG de SpaceX Il a félicité son équipe Pour réaliser cet exploit.
La mission de mardi visant à déployer 23 satellites Starlink en orbite a décollé du Kennedy Space Center en Floride à 18 h 17 HE. SpaceX a diffusé en direct la mission historique sur les réseaux sociaux :
Moteurs à pleine puissance et décollage ! pic.twitter.com/FeW78mZio2
– EspaceX (@SpaceX) 23 avril 2024
Environ huit minutes après le lancement, le premier étage de la fusée Falcon 9 a effectué un atterrissage droit parfait à bord du drone Just Read the Instructions stationné dans l'océan Atlantique. Regardez le booster de 41,2 mètres effectuer le 300ème atterrissage du booster Falcon 9 :
Le premier étage du Falcon 9 a atterri sur le drone Just Read the Instructions, complétant ainsi le 300ème atterrissage du Falcon ! pic.twitter.com/1YHqiHWjkN
– EspaceX (@SpaceX) 23 avril 2024
L'atterrissage du premier étage du booster de cette manière permet à SpaceX d'effectuer des missions à un coût bien inférieur à celui s'il devait construire une nouvelle mission pour chaque vol. Il est également devenu possible d'obtenir une fréquence de tir plus élevée. La société a construit plusieurs boosters Falcon 9 qui ont volé plusieurs fois au fil des ans. La mission de mardi était le neuvième vol de cette fusée particulière, qui a déjà lancé Crew-6, SES O3b mPOWER, USSF-124 et maintenant six missions Starlink.
Le record de vol actuel détenu par une seule fusée SpaceX appartient à Booster 1062, qui a été lancé et atterri plus tôt ce mois-ci pour une 20e fois record.
SpaceX a réalisé son premier atterrissage d'appoint en 2015 après avoir connu un certain nombre d'accidents au cours desquels le véhicule a atterri avec trop de force ou est tombé après l'atterrissage. L’équipe a atteint 200 atterrissages en juin dernier, et comme SpaceX augmente régulièrement son taux de lancement, le 400e atterrissage aura probablement lieu encore plus rapidement.
Recommandations des rédacteurs

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
science
La sonde spatiale Voyager 1 transmet à nouveau des données après que la NASA les a détectées à distance à 24 milliards de kilomètres – The Irish Times
:quality(70):focal(955x387:965x397)/cloudfront-eu-central-1.images.arcpublishing.com/irishtimes/F25H742JEFAG6EW6JFDXDFWGZQ.jpg)
Le vaisseau spatial le plus éloigné de la Terre, Voyager 1, a recommencé à communiquer correctement avec la NASA après que les ingénieurs ont travaillé pendant des mois pour réparer à distance la sonde vieille de 46 ans.
Le Jet Propulsion Laboratory de la NASA, qui construit et exploite le vaisseau spatial robotique de l'agence, a déclaré en décembre que la sonde, située à plus de 24 milliards de kilomètres, envoyait un code absurde à la Terre.
Dans une mise à jour publiée lundi, le JPL a annoncé que l’équipe de la mission avait pu « après quelques investigations innovantes » obtenir des données utilisables sur la santé et l’état des systèmes d’ingénierie de Voyager 1. « La prochaine étape consiste à permettre au vaisseau spatial de commencer à apporter les données scientifiques. dos. » Elle a ajouté que malgré le défaut, Voyager 1 fonctionnait normalement depuis le début.
Lancé en 1977, Voyager 1 a été conçu dans le but principal d'effectuer des études rapprochées de Jupiter et de Saturne au cours d'une mission de cinq ans. Cependant, son voyage s'est poursuivi et le vaisseau spatial approche désormais d'un demi-siècle d'exploitation.
Voyager 1 a pénétré dans l'espace interstellaire en août 2012, ce qui en fait le premier objet fabriqué par l'homme à quitter le système solaire. Il roule actuellement à une vitesse de 60 821 km/h.
Le dernier problème était lié à l'un des trois ordinateurs à bord du vaisseau spatial, chargé de remplir les données scientifiques et techniques avant de les envoyer sur Terre. Incapable de réparer une puce cassée, l'équipe du JPL a décidé de déplacer le code endommagé ailleurs, une tâche difficile compte tenu de la technologie obsolète.
Les ordinateurs de Voyager 1 et de sa sœur Voyager 2 disposaient de moins de 70 kilo-octets de mémoire au total, soit l'équivalent d'une image informatique à basse résolution. Ils utilisent de vieilles bandes numériques pour enregistrer des données.
La réparation a été envoyée depuis la Terre le 18 avril, mais il a fallu deux jours pour évaluer si elle a réussi, car il faut environ 22 heures et demie pour que le signal radio atteigne Voyager 1 et 22 heures supplémentaires pour que la réponse revienne sur Terre. .
« Lorsque l'équipe de vol de la mission a reçu une réponse du vaisseau spatial le 20 avril, elle a constaté que la modification fonctionnait », a déclaré le JPL.
Parallèlement à son annonce, le JPL a publié une photo des membres de l'équipe de vol du Voyager applaudissant et applaudissant dans une salle de conférence après avoir reçu des données utilisables, avec des ordinateurs portables, des cahiers et des cookies sur la table devant eux.
L'astronaute canadien à la retraite Chris Hadfield, qui a participé à deux missions de navette spatiale et a servi comme commandant de la Station spatiale internationale, a comparé la mission du JPL à l'entretien longue distance d'une vieille voiture.
« Imaginez qu'une puce informatique se brise dans votre voiture en 1977. « Imaginez maintenant qu'elle se trouve dans l'espace interstellaire, à 25 milliards de kilomètres de là », a écrit Hadfield.
Voyager 1 et 2 ont fait de nombreuses découvertes scientifiques, notamment des enregistrements détaillés de Saturne et la révélation que Jupiter possède également des anneaux, ainsi qu'une activité volcanique active sur l'une de ses lunes, Io. Des sondes ont ensuite découvert 23 nouvelles lunes autour des planètes extérieures.
Parce que leur trajectoire les éloigne du Soleil, les sondes du Voyager sont incapables d'utiliser des panneaux solaires et convertissent à la place la chaleur générée par la désintégration radioactive naturelle du plutonium en électricité pour alimenter les systèmes du vaisseau spatial.
La NASA espère continuer à collecter des données des deux vaisseaux spatiaux Voyager pendant encore plusieurs années, mais les ingénieurs s'attendent à ce que les sondes soient trop hors de portée pour communiquer d'ici une décennie environ, en fonction de la quantité d'énergie qu'elles peuvent générer. Voyager 2 est un peu en retard sur son jumeau et se déplace un peu plus lentement.
Dans environ 40 000 ans, les deux sondes passeront relativement près, en termes astronomiques, de deux étoiles. Voyager 1 s'approchera à moins de 1,7 années-lumière d'une étoile de la constellation de la Petite Ourse, tandis que Voyager 2 s'approchera à une distance similaire d'une étoile appelée Ross 248 dans la constellation d'Andromède. -Gardien

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
-
entertainment2 ans ago
Découvrez les tendances homme de l’été 2022
-
Top News2 ans ago
Festival international du film de Melbourne 2022
-
Tech1 an ago
Voici comment Microsoft espère injecter ChatGPT dans toutes vos applications et bots via Azure • The Register
-
science2 ans ago
Les météorites qui composent la Terre se sont peut-être formées dans le système solaire externe
-
science3 ans ago
Écoutez le « son » d’un vaisseau spatial survolant Vénus
-
Tech2 ans ago
F-Zero X arrive sur Nintendo Switch Online avec le multijoueur en ligne • Eurogamer.net
-
entertainment1 an ago
Seven révèle son premier aperçu du 1% Club
-
entertainment1 an ago
Centenaire des 24 Heures – La musique live fournit une bande-son pour la course