science
Les nouvelles découvertes expliquent un casse-tête de longue date de la cellule

Cette gouttelette de liquide est en fait composée de molécules de protéines. Il agit comme la colle qui maintient le microtubule attaché, via le transport de protéines motrices, à un câble d’actine – un processus essentiel à la poursuite de la division cellulaire. Crédit : Ella Marushenko / Ella Maru Studios
Amélioré par la nature au cours de 100 millions d’années d’évolution, le fluide intelligent fournit un couplage critique qui garantit que la division cellulaire continue de fonctionner correctement.
des savants qui Institut Paul Scherrer Et ETH Zurich Découvrez le mécanisme par lequel les protéines forment de minuscules gouttelettes liquides qui agissent comme un adhésif intelligent dans les cellules. Ces gouttelettes se fixent aux extrémités des microtubules, aidant à positionner correctement le noyau cellulaire pendant la division. Recherche publiée dans Biologie Cellulaire Natureexplique le mystère de longue date de la façon dont les structures de protéines mobiles dans les cellules s’attachent les unes aux autres.
Les liaisons entre les pièces mobiles des machines sont essentielles à leur bon fonctionnement. Qu’elles soient rigides ou flexibles, comme la liaison entre les arbres d’un moteur ou les joints d’une carrosserie, les propriétés des matériaux garantissent la bonne transmission des efforts mécaniques. Cela est particulièrement vrai dans les cellules, où les interactions entre les structures cellulaires en mouvement sont essentielles à de nombreux processus biologiques. Cependant, la façon dont la nature réalise ce couple a longtemps intrigué les scientifiques.
Or, des chercheurs étudiant un couplage important dans la division cellulaire de la levure ont révélé que pour ce faire, les protéines coopèrent pour se condenser en une gouttelette liquide. L’étude était une collaboration entre les équipes de Michel Steinmetz de l’Institut Paul Scherrer PSI et d’Yves Barral de l’ETH Zurich, avec l’aide des groupes d’Eric Dufresne et de Jörg Stelling, tous deux de l’ETH Zurich.
En formant une gouttelette liquide, les protéines atteignent des propriétés matérielles idéales pour assurer la fonction biologique. Cette découverte n’est que le début d’une nouvelle compréhension du rôle que jouent les fluides intelligents dans la cellule, estime Baral, dont le groupe de recherche étudie le processus de division cellulaire chez la levure. « Nous découvrons que les fluides composés de biomolécules peuvent être très complexes et présenter une bien plus grande variété de propriétés que celles auxquelles nous sommes habitués de notre point de vue macroscopique. À cet égard, je pense que nous allons découvrir que ces fluides ont des propriétés fascinantes. » qui ont été sélectionnés par l’évolution sur des centaines de millions d’années.
Microtubules : diagonales de la cellule
L’étude se concentre sur le couplage qui se produit aux extrémités des microtubules – des filaments qui sillonnent le cytoplasme de la cellule et ressemblent de manière troublante à des tentacules extraterrestres. Ces tubes creux, formés à partir du bloc de construction de la tubuline, agissent comme un tube de traction, transportant diverses charges à travers la cellule.
Les microtubules reçoivent l’une de leurs charges utiles les plus importantes lors de la division cellulaire. Chez la levure, ils ont la fonction importante de tirer le noyau, qui contient les chromosomes en division, entre les cellules mère et fille. Pour ce faire, les microtubules doivent se connecter, via une protéine motrice, à un câble d’actine ancré à la membrane cellulaire de la cellule fille émergente. La protéine motrice marche ensuite le long du câble d’actine, tirant le microtubule dans la cellule fille jusqu’à ce que sa précieuse cargaison de matériel génétique atteigne sa destination prévue entre les deux cellules.
Cette conjugaison, qui est essentielle pour la poursuite de la division cellulaire, doit résister à la tension au fur et à mesure que la protéine motrice progresse et permettre au noyau de manœuvrer avec précision. Michel Steinmetz, dont le groupe de recherche au PSI est expert en biologie structurale des microtubules, explique : « Entre les microtubules et la protéine motrice, il doit y avoir de la colle. Sans elle, si le microtubule se casse, on se retrouve avec une cellule fille qui ne contient pas de matériel génétique et ne survivra pas.
Accouplement naturel élastique
Chez la levure, trois protéines, qui forment le cœur du réseau dit Kar9, ornent la pointe du microtubule pour réaliser ce couplage. La façon dont ils obtiennent les propriétés matérielles nécessaires semble être en contradiction avec la compréhension traditionnelle des interactions protéiques.
Une question qui a longtemps intrigué les scientifiques est de savoir comment les trois protéines centrales du réseau Kar9 restent attachées à l’extrémité du microtubule même lorsque des sous-unités de tubuline sont ajoutées ou supprimées : l’équivalent d’un crochet à l’extrémité d’une corde de remorquage restant en place tandis que les segments adjacents de la corde sont insérés. ou le couper. Ici, leur découverte offre une réponse : tout comme une goutte de colle liquide peut s’accrocher au bout d’un crayon, cette protéine « liquide » peut s’accrocher à l’extrémité d’un microtubule alors même qu’il grossit ou rétrécit.
Les chercheurs ont découvert que pour obtenir cette propriété fluide, les trois protéines centrales du réseau Kar9 coopèrent via un réseau d’interactions faibles. Lorsque les protéines interagissent à un certain nombre de points différents, si une interaction échoue, les autres restent et la « colle » continue à se serrer les coudes. Les chercheurs pensent que cela confère la flexibilité nécessaire pour que les microtubules restent attachés à la protéine motrice même sous tension.
Pour parvenir à leur découverte, les chercheurs ont systématiquement étudié les interactions entre les trois composants protéiques du réseau Kar9. Basé sur les connaissances structurelles acquises à Swiss Light Source[{ » attribute= » »>SLS in previous studies, they could mutate the proteins to selectively remove interaction sites and observe the effects in vivo and in vitro.
In solution, the three proteins came together to form distinct droplets, like oil in water. To prove that this was occurring in yeast cells, the researchers investigated the effect of mutations on cell division and the ability of the proteins to track the end of a shrinking microtubule.
“It was fairly straightforward to prove the proteins were interacting to form a liquid condensate in vitro. But it was a huge challenge to provide compelling evidence that this is what was happening in vivo, which took us several years,” explains Steinmetz, who first postulated the idea of a ‘liquid protein glue’ for microtubule-tip binding proteins together with a colleague from the Netherlands in a 2015 review publication.
Not your bog-standard multipurpose glue
Barral is struck by how sophisticated the glue is. “It is not just a glue, but it is a smart glue, which is able to integrate spatial information to form only at the right place.” Within the complex tangle of identical microtubules in the cell cytoplasm, just one microtubule receives the droplet that enables it to attach to the actin cable and pull the genetic information into place. “How nature manages to assemble a complex structure on the end of just one microtubule, and not others, is mindboggling,” he emphasizes.
The researchers believe that the liquid property of the proteins plays an important role in achieving this specificity. In the same way that small oil droplets in a vinaigrette fuse together, they hypothesize that small droplets initially form on many microtubules, which somehow subsequently converge to form one larger droplet on a single microtubule. How exactly this is achieved remains a mystery and is the subject of investigations in the Steinmetz and Barral teams.
Reference: “Multivalency ensures persistence of a +TIP body at specialized microtubule ends” by Sandro M. Meier, Ana-Maria Farcas, Anil Kumar, Mahdiye Ijavi, Robert T. Bill, Jörg Stelling, Eric R. Dufresne, Michel O. Steinmetz and Yves Barral, 19 December 2022, Nature Cell Biology.
DOI: 10.1038/s41556-022-01035-2
The study was funded by the Swiss National Science Foundation

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
science
Tester une nouvelle technologie de cartographie 3D pour transformer l’exploration spatiale et bénéficier aux industries sur Terre

Centre spatial Kennedy, Floride., 26 avril 2024 /PRNewswire/ — Lorsque vous partez en voyage, vous pouvez rechercher une carte pour vous aider à naviguer dans votre voyage ou allumer le GPS sur votre téléphone. Mais que se passe-t-il si la destination est sur une autre planète et qu’il n’y a pas de carte ? Un nouveau projet parrainé par le Laboratoire national de la Station spatiale internationale (ISS) peut aider. Cette enquête, appelée Multi-Resolution Scanner (MRS), exploitera le système robotique volant libre Astrobee de la NASA sur la station spatiale pour tester une nouvelle technologie de cartographie 3D capable de produire des cartes détaillées d'environnements distants.
Le projet, une collaboration entre Boeing et le CSIRO (une agence gouvernementale australienne responsable de la recherche scientifique), souligne l'importance des partenariats internationaux tout en s'appuyant sur la riche histoire du duo dans l'industrie spatiale mondiale. comme Australie L'agence scientifique nationale, le CSIRO, a contribué de manière significative au secteur spatial. Par exemple, lors de l'alunissage d'Apollo 11 en 1969, le radiotélescope Parkes du CSIRO, Moreang, a reçu des signaux de télévision de cet événement historique qui ont été regardés par près de 600 millions de téléspectateurs dans le monde. Aujourd’hui, l’organisation travaille sur un projet qui profitera non seulement aux futures missions d’exploration, mais également aux principales industries de la planète.
MRS est conçu pour créer rapidement des cartes 3D de divers environnements avec des détails sans précédent, comme une station spatiale ou même un tube de lave sur la Lune ou sur Mars. « Nous utiliserons les robots volants libres Astrobee de la NASA pour tester le MRS, ce qui nous permettra de créer des cartes 3D du module Kibo de la station spatiale », a déclaré Mark Elmotti, chef du groupe de recherche au CSIRO. « La technologie que nous utilisons combine plusieurs capteurs, ce qui compense les faiblesses de chacun d'entre eux et fournit des données de trajectoire 3D haute résolution et plus précises pour comprendre comment le robot se déplace dans l'espace. »
Que ce soit à bord de la station spatiale ou à la surface de Mars, les explorateurs robotiques doivent utiliser des capteurs embarqués et des algorithmes de perception pour construire des cartes détaillées de l'environnement tout en déterminant simultanément leur emplacement au sein de celui-ci. Cette capacité est appelée localisation et mappage simultanés, ou SLAM. MRS s'appuie sur un logiciel de photogrammétrie avancé appelé Stereo-Depth Fusion et sur la technologie 3D SLAM, que le CSIRO appelle Wildcat. Le logiciel permet au MRS de cartographier, d’analyser et de naviguer de manière indépendante dans son environnement.
Pour vérifier que le programme fonctionne dans l'espace, Elmuti et son équipe cartographient un emplacement connu sur la station spatiale : le module Kibo. L'enquête sur la station spatiale a débuté en mars La 30e mission de services de réapprovisionnement commercial (CRS) de SpaceX, sous contrat avec la NASA. Une fois arrivé à la station, le MRS a été installé dans l'un des trois robots Astrobee.
Commencer avec Kibo permet à l’équipe de vérifier les cartes résultantes et de les comparer avec des contrôles pour voir dans quelle mesure la technologie fonctionne en microgravité. Des expériences au sol antérieures ont montré que les capacités de cartographie et de positionnement très précises du logiciel peuvent permettre à des robots comme Astrobee de naviguer avec succès dans des environnements dangereux, complexes et non structurés sans GPS ou autres informations de positionnement externes.
En cas de succès, MRS pourrait s'étendre à d'autres modules de la station spatiale, augmentant ainsi ses capacités de cartographie. Les résultats de cette enquête contribueront à faire progresser la technologie au point où elle pourra être utilisée dans les futures missions de vols spatiaux et les efforts d’exploration. La Station spatiale internationale est habitée en permanence depuis plus de 20 ans, mais les futures stations spatiales ne seront peut-être pas toutes habitées par des humains. La passerelle lunaire prévue par la NASA, ainsi que d'autres avant-postes dans l'espace, pourraient être peuplés principalement de robots. Cette technologie permettra aux assistants robotiques de maintenir les systèmes en fonctionnement autonome lorsque les humains ne sont pas là.
« Boeing s'engage à fournir des capacités améliorées et une sécurité renforcée pour les vols vers la Lune et au-delà », a-t-elle déclaré. Scott CopelandDirecteur de l'intégration de la recherche sur la Station spatiale internationale chez Boeing. « Cela nécessite l'intersection des missions de l'équipage et des robots, et la technologie de numérisation multi-résolution démontrée à bord de notre banc d'essai en orbite terrestre basse sera un outil puissant pour nous aider à atteindre ces objectifs. »
Nous verrons peut-être un jour une version du MRS sur d’autres planètes, installée sur des rovers ou des hélicoptères qui utilisent cette technologie pour cartographier le terrain et explorer des ressources précieuses. MRS peut également identifier les dommages potentiels causés aux engins spatiaux dus à des micrométéorites ou à d’autres impacts, ce qui est particulièrement utile sur les sites sans équipage de manière continue, renforçant ainsi la valeur des robots soignants. La technologie MRS peut également bénéficier à de nombreuses industries sur Terre, telles que l’exploitation minière et les secours en cas de catastrophe.
Apprenez-en davantage sur Astrobees et sur la manière dont d'autres enquêtes parrainées par le Laboratoire national de l'ISS utilisent des assistants robotiques dans le dernier numéro de en haut®le journal officiel du Laboratoire national de la Station spatiale internationale. est en train de lire « Robots volants libres dans l'espace : comment de vrais robots testent les nouvelles technologies. »
Pour télécharger une image haute résolution de cette version, cliquer ici.
À propos du Laboratoire national de la Station spatiale internationale :
La Station spatiale internationale (ISS) est un laboratoire unique qui permet des recherches et des développements technologiques impossibles sur Terre. En tant qu'institution de service public, le Laboratoire national de l'ISS permet aux chercheurs de tirer parti de cette installation multi-utilisateurs pour améliorer la qualité de vie sur Terre, faire évoluer les modèles commerciaux spatiaux, faire progresser les connaissances scientifiques de la main-d'œuvre future et développer un marché durable et évolutif dans les pays à faible revenu. pays à revenus. L'orbite terrestre. Grâce à ce laboratoire national en orbite, les ressources de recherche de l'ISS sont disponibles pour soutenir les initiatives scientifiques, technologiques et éducatives non-NASA émanant d'agences gouvernementales américaines, d'établissements universitaires et du secteur privé. Le Centre pour l'avancement de la science dans l'espace (CASIS™) gère le Laboratoire national de la Station spatiale internationale, dans le cadre d'un accord de coopération avec la NASA, facilitant l'accès à un environnement de recherche permanent en microgravité, à un point d'observation puissant en orbite terrestre basse et à des conditions difficiles. et des conditions diverses. depuis l'espace. Pour en savoir plus sur le Laboratoire national de la Station spatiale internationale, visitez Notre emplacement.
En tant qu'organisation à but non lucratif de type 501(c)(3), CASIS accepte les dons d'entreprises et de particuliers pour contribuer à faire progresser la science dans l'espace au profit de l'humanité. Pour plus d'informations, visitez notre site web Page de dons.
|
|
|
6905 N. Wickham Road, Suite 500, Melbourne, FL 32940 · 321.253.5101 · www.ISSNationalLab.org |
Source : Laboratoire national de la Station spatiale internationale

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
science
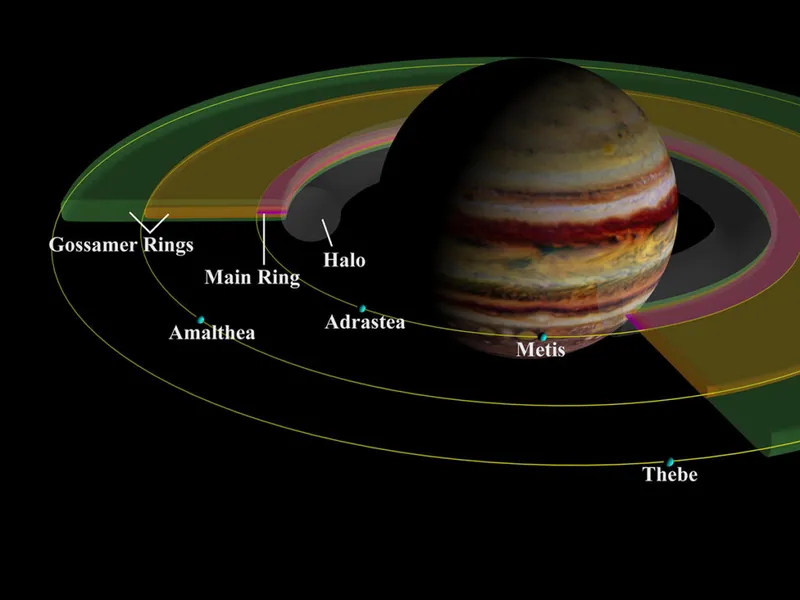
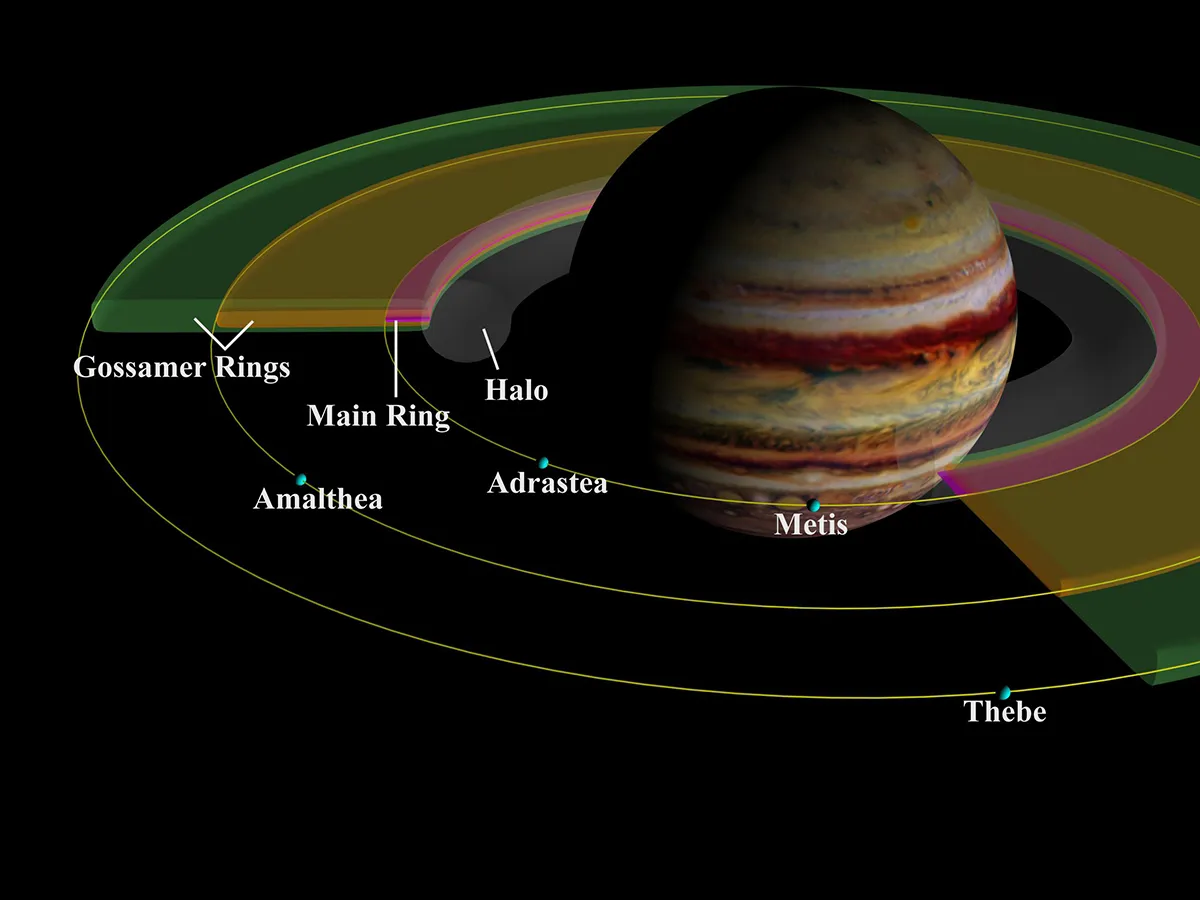
Jupiter a-t-il des anneaux ? Oui elle est comme ça

Nous connaissons tous les anneaux magiques de Saturne, mais Jupiter a-t-il des anneaux ? Oui elle est comme ça.
Eh bien, Jupiter n'a pas de grands anneaux clairement définis comme celui de Saturne, mais ils existent.
En fait, les anneaux de Jupiter sont si faibles qu'ils sont invisibles à l'œil nu et extrêmement difficiles à détecter, même avec des télescopes puissants. Mais ils sont bel et bien là.
Ils ont été observés et photographiés par les vaisseaux spatiaux Voyager et Galileo, la mission Cassini, le télescope Keck et, plus récemment, par le télescope spatial James Webb.
Combien d’anneaux Jupiter a-t-il ?
Jupiter possède quatre structures annulaires principales.
En regardant vers l'extérieur de la planète elle-même, il y a un épais « anneau corona » intérieur, d'une épaisseur de 12 500 km.
Puis « l'anneau principal » qui est très brillant et très fin, seulement 30 kilomètres d'épaisseur par endroits.
Et deux « anneaux fins » épais mais très ternes.
L'anneau aréolaire est de couleur neutre ou bleuâtre, tandis que les anneaux principal et filamenteux ont une couleur rougeâtre.
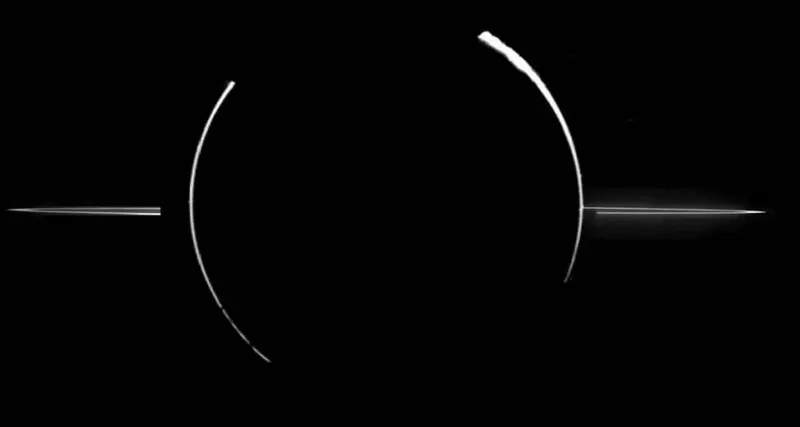
Formation des anneaux de Jupiter
On pense que les anneaux entourant Jupiter sont constitués de matériaux – principalement sous la forme de très fines particules de poussière – précédemment éjectés des lunes Metis et Adrastia à la suite de collisions avec des astéroïdes, des météorites ou des comètes.
La question de savoir si les anneaux sont aussi vieux que Jupiter lui-même ou s'ils se sont formés plus tard est une question à laquelle on n'a pas encore répondu.

Découverte
Les anneaux de Jupiter sont si faibles que nous n'avions aucune idée de leur existence jusqu'à ce que les images soient renvoyées par la sonde spatiale Voyager 1 en 1979.
Ce que nous en savons aujourd'hui provient principalement des images supplémentaires réalisées par les missions Galileo et Cassini de la NASA à la fin des années 1990 et au début des années 2000, ainsi que des observations faites par le télescope spatial Hubble et le télescope Keck au sol.
Les scientifiques pensent maintenant que c'est la gravité des quatre grandes lunes galiléennes de Jupiter (Ganymède, Callisto, Io et Europe) qui a empêché Jupiter de former de grands anneaux sophistiqués comme ceux entourant sa voisine géante gazeuse, Saturne.
Photos des anneaux de Jupiter

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
science
Les astronautes sont ravis d'effectuer le premier vol d'essai à bord du vaisseau spatial Starliner de Boeing

Deux astronautes vétérans se sont rendus au Centre spatial Kennedy jeudi après-midi pour préparer le premier lancement d'essai du vaisseau spatial Starliner de Boeing, un vol très attendu depuis des années. En retard Après deux Vols d'essai sans pilote Et un travail approfondi pour résoudre une variété de problèmes techniques.
Les astronautes Barry « Butch » Wilmore et Sunita Williams, deux des astronautes les plus expérimentés de la NASA avec quatre vols spatiaux précédents, 11 sorties dans l'espace et 500 jours en orbite entre ces périodes, ont atterri sur la piste de 3 miles de long du port spatial à bord d'un avion d'entraînement à réaction T-38. après le vol. Du Centre spatial Johnson à Houston.
NASA/Frank Michaud
« Nous aimons la Floride », a déclaré Wilmore aux journalistes sur la piste, « Nous aimons le Kennedy Space Center, parce que c'est là que vous lancez des gens dans l'espace. » « Dans moins de deux semaines, le prochain vol que nous prendrons se fera sur notre dos et prendra son envol. »
L'achèvement du vol d'essai de l'équipage Starliner, ou CFT, « augmentera la capacité (de la NASA) vers et depuis la station spatiale, et c'est essentiel », a-t-il déclaré. «Nous sommes ravis d'être ici.»
« C'est là que le caoutchouc rencontre la route », a déclaré Williams, « et là où nous quittons cette planète, et c'est plutôt cool ! »
Quelques heures après l'arrivée de l'équipage, et peu après que deux astronautes russes ont effectué une sortie dans l'espace de quatre heures et 36 minutes à l'extérieur de la Station spatiale internationale, les chefs de mission ont effectué un examen de préparation au vol de deux jours, autorisant provisoirement le lancement du véhicule Starliner à bord de l'avion. Véhicule de lancement uni. Fusée Alliance Atlas 5 à 22 h 34 HAE le lundi 6 mai.
Si tout va bien, Wilmore et WilliamsTous deux anciens pilotes d'essai de la Marine, ils accosteront à la station spatiale le 8 mai et reviendront sur Terre le 15 mai ou peu après. Si la mission se déroule bien, la NASA prévoit de commencer les vols opérationnels de rotation de l'équipage du Starliner en 2025, en alternance avec SpaceX.
« Aujourd'hui a été un grand jour pour notre programme d'équipage commercial », a déclaré Steve Stich, administrateur du CCP de la NASA. « Tous les partenaires (internationaux), puis toute notre équipe, ont mené une enquête préalable pour procéder au lancement le 6 mai. De plus, nous avons (signé) ce que nous appelons la qualification humaine provisoire pour Starliner pour ce vol avec équipage. test. C’était une grosse affaire pour la NASA et toute notre équipe.
Al-Ula
La NASA a attribué deux contrats pour le programme d'équipage commercial en 2014, l'un à SpaceX d'une valeur de 2,6 milliards de dollars et l'autre à Boeing d'une valeur de 4,2 milliards de dollars, pour stimuler le développement d'engins spatiaux autonomes capables de transporter des astronautes vers et depuis la Station spatiale internationale.
L’objectif était de mettre fin à la dépendance à l’égard du vaisseau spatial russe Soyouz après le retrait de la navette spatiale et de reprendre le lancement d’astronautes américains depuis le sol américain à bord de fusées et d’engins spatiaux américains. Il est tout aussi important pour la NASA de disposer de deux vaisseaux spatiaux indépendants pour les vols d'équipage vers la Station spatiale internationale au cas où le ferry d'une entreprise s'arrêterait avant la Terre pour une raison quelconque.
SpaceX a commencé les vols d'essai en mai 2020, lançant avec succès deux astronautes de la NASA lors d'un vol d'essai Crew Dragon vers la station spatiale. Depuis lors, SpaceX a lancé 50 astronautes, astronautes et civils en orbite sur huit vols opérationnels vers le complexe de laboratoires, trois visites commerciales et un vol financé par des fonds privés vers une orbite terrestre basse.
Boeing a lancé son Starliner dans un avion Vol d'essai sans pilote En décembre 2019, le vaisseau spatial a rencontré des problèmes logiciels et de communication majeurs qui se sont combinés pour entraver la tentative d'amarrage à la station spatiale et ont presque conduit à la destruction du vaisseau de l'équipage.
une Le deuxième vol sans pilote Il a été commandé (et payé par Boeing), mais lors de la fenêtre de lancement d'août 2021, les ingénieurs des fenêtres ont découvert des valves corrodées dans le système de propulsion du vaisseau spatial. La résolution de ce problème a retardé le deuxième vol d’essai jusqu’en mai 2022.
Bien que la mission ait été un succès, d'autres problèmes ont été découverts, notamment des problèmes de parachute et des inquiétudes concernant la possibilité que le ruban de protection enroulé autour du câblage interne s'enflamme. La correction de ces problèmes et la recherche d'une place pour la visite dans le programme de vol complexe de la station spatiale ont finalement retardé le test en vol de l'équipage au 6 mai.
Accorder Problèmes récents Avec des avions Boeing qui ont soulevé des questions sur l'entreprise Culture de sécuritéLe test en vol réussi de l'équipage est considéré par beaucoup comme une étape cruciale pour Boeing et le programme d'équipage commercial de la NASA.
Pour sa part, Wilmore a déclaré qu'il ne considérait pas le lancement du Starliner dans le contexte des problèmes de l'avion largement rapportés par Boeing.
NASA
« Je ne pense pas qu'il s'agisse nécessairement de Boeing ou d'un vol », a-t-il déclaré. « Ils sont tous d'une importance vitale. Il s'agit des vols spatiaux habités. Cet adage que vous avez entendu depuis Apollo 13, selon lequel l'échec n'est pas une option ? Cela n'a rien à voir spécifiquement avec Boeing ou ce programme. Ce sont toutes les choses que nous faisons dans l'espace humain. vol spatial. » .
« Donc, ce n’est ni plus ni moins important que tout ce que nous faisons », a-t-il déclaré. « Il se trouve que c'est la chose la plus importante que nous faisons en ce moment. »
« Le succès de cette mission a toujours été très important pour nous en tant que programme pour de nombreuses raisons », a reconnu Mark Nappi, responsable du programme Starliner de Boeing.
« Premièrement, nous avons des humains qui pilotent ce véhicule », a-t-il déclaré. « Nous prenons cela très au sérieux dans le domaine des vols spatiaux habités. J'ai passé ma carrière dans ce secteur et cela a toujours été en tête de liste. »
« Deuxièmement, il s'agit d'une capacité importante pour nous et pour la NASA, c'est pourquoi nous nous sommes engagés à le faire, et nous allons le faire et y parvenir. Je n'y pense donc pas en termes de ce qui est important pour Boeing. autant j'y pense en termes de ce qui est important pour ce programme, ce qui est important « Donner suite aux engagements que nous avons pris envers nos clients ».

« Spécialiste de la télévision sans vergogne. Pionnier des zombies inconditionnels. Résolveur de problèmes d’une humilité exaspérante. »
-
entertainment2 ans ago
Découvrez les tendances homme de l’été 2022
-
Top News2 ans ago
Festival international du film de Melbourne 2022
-
Tech1 an ago
Voici comment Microsoft espère injecter ChatGPT dans toutes vos applications et bots via Azure • The Register
-
science2 ans ago
Les météorites qui composent la Terre se sont peut-être formées dans le système solaire externe
-
science3 ans ago
Écoutez le « son » d’un vaisseau spatial survolant Vénus
-
Tech2 ans ago
F-Zero X arrive sur Nintendo Switch Online avec le multijoueur en ligne • Eurogamer.net
-
entertainment1 an ago
Seven révèle son premier aperçu du 1% Club
-
entertainment1 an ago
Centenaire des 24 Heures – La musique live fournit une bande-son pour la course